¿Dónde se encuentra la terapia contra el cáncer CAR-T después de su aprobación por la FDA?
Después de ser aprobada por la FDA, la terapia del cáncer de células T con CAR progresa en su tratamiento de pacientes pediátricos.
Agosto de 2021 marca el cuarto año desde que la Administración de Drogas y Alimentos de los EE. UU (FDA). aprobó la terapia celular que implementa células T receptoras de antígenos quiméricos especializados para el tratamiento del cáncer.
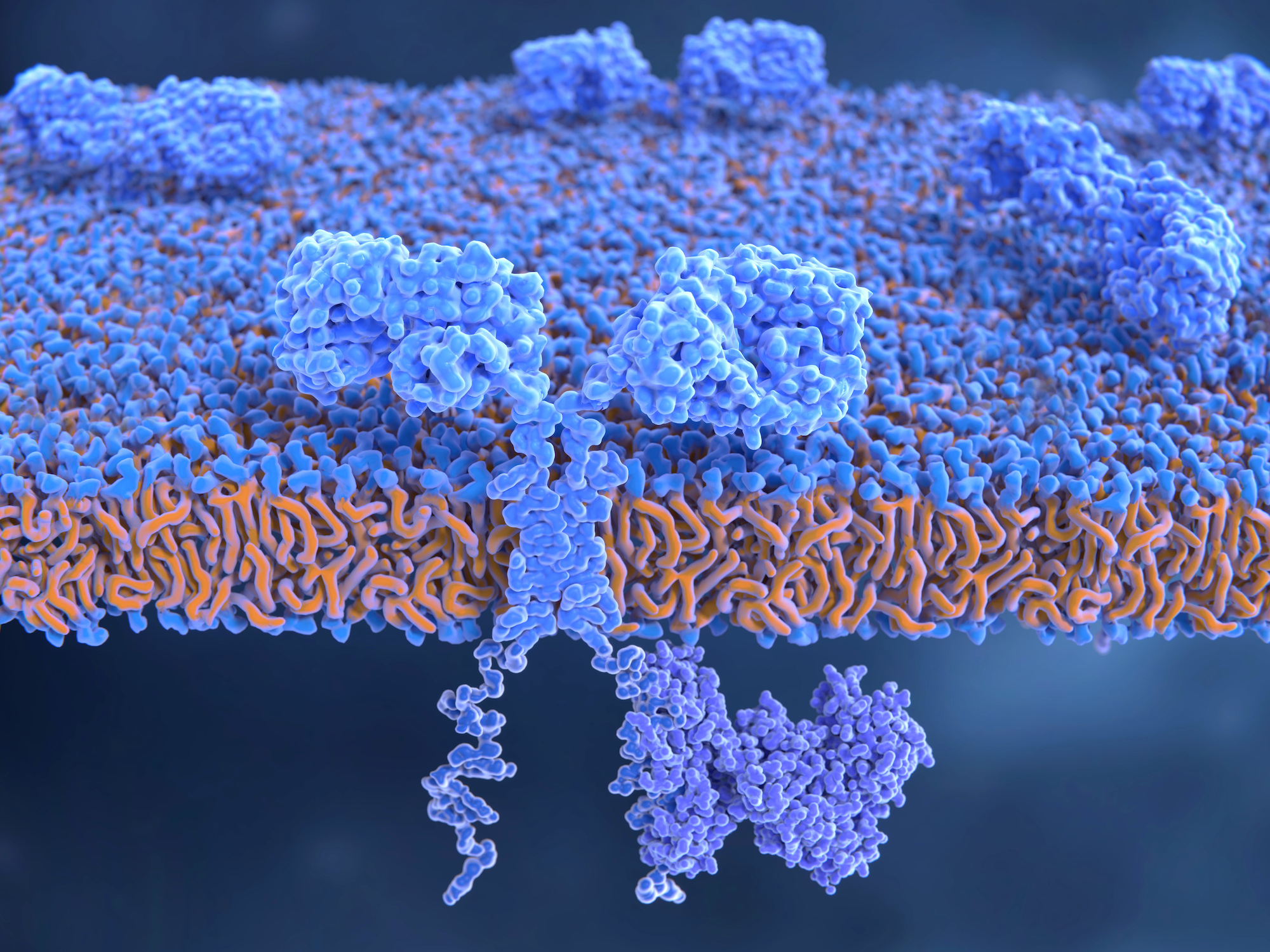
Estas células CAR T (como se las conoce coloquialmente) forman un tipo de proteína con células T modificadas genéticamente que están diseñadas para replicar un receptor de células T artificial utilizado clínicamente en inmunoterapia. A diferencia de las células T preexistentes y formadas de forma natural, estas células CAR T pueden dirigirse a ciertas proteínas, específicamente a las células cancerosas que invaden el cuerpo.
En un esfuerzo por mejorar la inmunoterapia contra el cáncer y comercializar el tratamiento introducido por las células T con CAR, la Universidad de Pensilvania junto con el Hospital Infantil de Filadelfia establecieron Kymriah ™ con Novartis y la Lymphoma Research Foundation para la terapia con células T con CAR.
Específicamente, la investigación y los ensayos clínicos en la Facultad de Medicina Perelman de Penn y CHOP trabajaron en colaboración con las instalaciones de Novartis para obtener la aprobación de la FDA.
Este avance fue especialmente positivo para los pacientes jóvenes que buscaron tratamiento para diversas formas de cáncer de sangre. Con las células CAR T, los pacientes podrían combatir el cáncer desde dentro.
El nuevo tratamiento alteraría las propias células T de los pacientes dentro del sistema inmunológico.
Luego, en una planta de fabricación de Novartis, las células se recolectarían y modificarían para crear células T CAR.
Finalmente, estas potenciales células CAR T distinguirían las células cancerosas de las sanas, y eventualmente destruirían las células leucémicas invasoras. La proteína específica a la que se dirigen en pacientes con leucemia se conoce como CD19.
Las células CAR T también actúan de manera similar a cualquier célula del sistema inmunológico dentro del cuerpo y se multiplican a velocidades rápidas, con incluso 10,000 nuevas células que se originan a partir de una nueva célula CAR T.
Como resultado de la ingeniería celular exitosa, los pacientes con leucemia han experimentado altas tasas de remisión.
Inicialmente, el tratamiento se creó para pacientes que padecían leucemia linfoblástica aguda (LLA) precursora de células B en fase refractaria, segundas etapas o recidiva.
En 2017, estos pacientes también podrían tener hasta 25 años de edad, pero a medida que la tecnología CAR T se sometió a numerosos ensayos clínicos, las edades de los pacientes se expandieron.
En un ensayo en UPenn y CHOP que implementó huCART19 en pacientes diagnosticados de LLA-B, las edades elegibles para el examen oscilaron entre 1 y 29 años. Sin embargo, la aplicación principal de estas células CAR T parece estar dentro de la atención pediátrica.
CONTENIDO RELACIONADO
La primera paciente pediátrica del mundo, Emily Whitehead, de seis años, pudo recibir tratamiento inyectando las células T CAR diseñadas después de buscar opciones de atención alternativas para su leucemia.
Después de un examen detenido, el cáncer de Whitehead parecía estar en remisión, similar a los resultados encontrados en ensayos clínicos más grandes.
El Abramson Cancer Center de Penn informó que después de cuatro años de la aprobación de la FDA y cinco años después del tratamiento inicial de las células T Kymriah ™ y CAR, los pacientes con linfoma no Hodgkin continúan su camino de remisión.
El autor principal Stephen J. Schuster, MD, director del Programa de Linfoma en el Abramson Cancer Center, y profesor asistente de Hematología-Oncología en la Escuela de Medicina Perelman Marco Ruella, MD, trabajó en la investigación de células T con CAR para descubrir los resultados de esta terapia celular aprobada por la FDA.
Según la revista de noticias de Penn Medicine, después de examinar a 24 pacientes con una forma agresiva de linfoma que recibieron tratamiento después de sus cánceres, regresaron con la atención estándar
"El cuarenta y seis por ciento logró una remisión completa y el 31% logró una supervivencia sin progresión a los cinco años", se lee en el informe de Penn Medicine.
Además, siguiendo a otros 14 pacientes con otra forma de linfoma no Hodgkin, "el 71% logró una remisión completa y el 43% logró una supervivencia libre de progresión a los cinco años".
Esta investigación específica subraya la atención de seguimiento más extendida relacionada con la terapia de células T con CAR.
Con datos oficiales publicados y una aprobación de la FDA, esta forma de inmunoterapia está demostrando ser eficaz tanto en pacientes pediátricos como adultos con linfomas de células B grandes (agresivos) en recaída o refractarios.










DEJE UN COMENTARIO: